PC开麦,例精图治 | 深度降酮、减少骨破坏风险
 在前列腺癌的疾病进展过程中,非转移性去势抵抗性前列腺癌(nmCRPC)是介于非转移性雄激素敏感性阶段和转移性去势抵抗性前列腺癌(mCRPC)之间的一个疾病状态。所以延缓nmCRPC的转移进程对于改善患者的预后至关重要。雄激素剥夺治疗(ADT)作为前列腺癌治疗的基石,在减缓疾病进展中发挥了关键作用,因此选择合适的ADT治疗策略尤为关键。ADT药物去势主要包括促性腺激素释放激素(GnRH)激动剂和GnRH拮抗剂。相较于GnRH激动剂,GnRH拮抗剂地加瑞克具有显著的优势。地加瑞克能够快速、持续地降低睾酮水平,避免了“闪烁现象”,从而更稳定地控制疾病进展。除此之外,GnRH拮抗剂地加瑞克可以显著提高患者无进展生存期(PFS),对前列腺特异性抗原(PSA)的控制更好,能够使疾病更晚进入到CRPC阶段。
在前列腺癌的疾病进展过程中,非转移性去势抵抗性前列腺癌(nmCRPC)是介于非转移性雄激素敏感性阶段和转移性去势抵抗性前列腺癌(mCRPC)之间的一个疾病状态。所以延缓nmCRPC的转移进程对于改善患者的预后至关重要。雄激素剥夺治疗(ADT)作为前列腺癌治疗的基石,在减缓疾病进展中发挥了关键作用,因此选择合适的ADT治疗策略尤为关键。ADT药物去势主要包括促性腺激素释放激素(GnRH)激动剂和GnRH拮抗剂。相较于GnRH激动剂,GnRH拮抗剂地加瑞克具有显著的优势。地加瑞克能够快速、持续地降低睾酮水平,避免了“闪烁现象”,从而更稳定地控制疾病进展。除此之外,GnRH拮抗剂地加瑞克可以显著提高患者无进展生存期(PFS),对前列腺特异性抗原(PSA)的控制更好,能够使疾病更晚进入到CRPC阶段。
对此,解放军总医院牛少曦教授分享了一例由低危前列腺癌进展为nmCRPC的典型病例。患者前列腺癌病史长达7年,入院后,术前接受比卡鲁胺联合GnRH拮抗剂地加瑞克治疗,游离前列腺特异性抗原(tPSA)水平迅速降低,随后进行根治性切除。术后随访中,患者tPSA水平呈升高趋势,进一步通过MRI和PSMA检查,诊断为nmCRPC。患者继续使用比卡鲁胺联合地加瑞克治疗。然而,随访过程中PSA仍持续升高,提示疾病可能进一步进展。后因相关症状再次入院,通过PSMA和PDG-PET检查,诊断为nmCRPC,同时基因检测发现存在部分基因发生突变。病情进一步评估后,患者接受膀胱肿瘤电切术进行切除,术后转为达罗他胺联合地加瑞克治疗,患者目前仍存活。针对以上分享的病例,解放军总医院王保军教授和中国医学科学院肿瘤医院张勇教授做出点评。
病例分享
病例一:
基本信息:患者,男,79岁。
主诉:尿痛伴血尿4日,确诊前列腺癌7年余。
现病史:于2017年因尿频尿急尿痛,血尿,在外院发现血PSA升高(8ng/ml),遂予以经直肠前列腺穿刺,穿刺病理:前列腺癌Gleason评分为3+3=6分。病理学诊断:前列腺癌(低危),临床分期:T2NxMx。
相关检查:
盆腔MRI:前列腺顶部左侧DWI高信号,考虑前列腺癌。
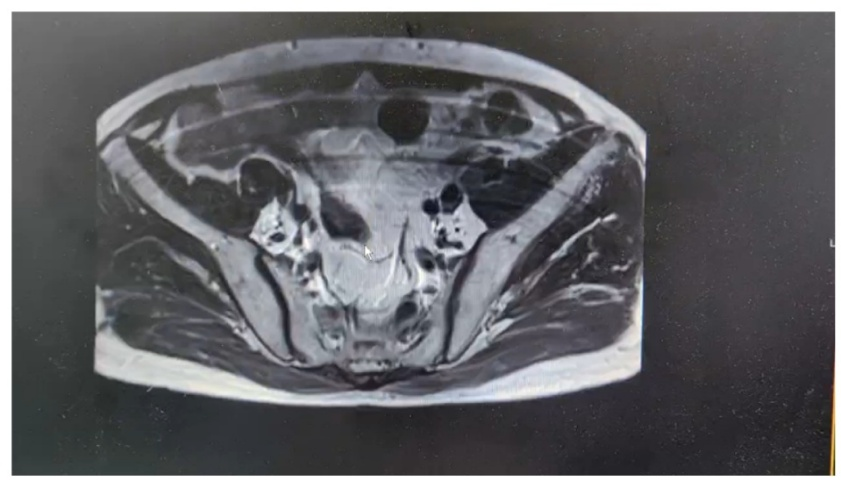
图1 MRI检查
超声检查
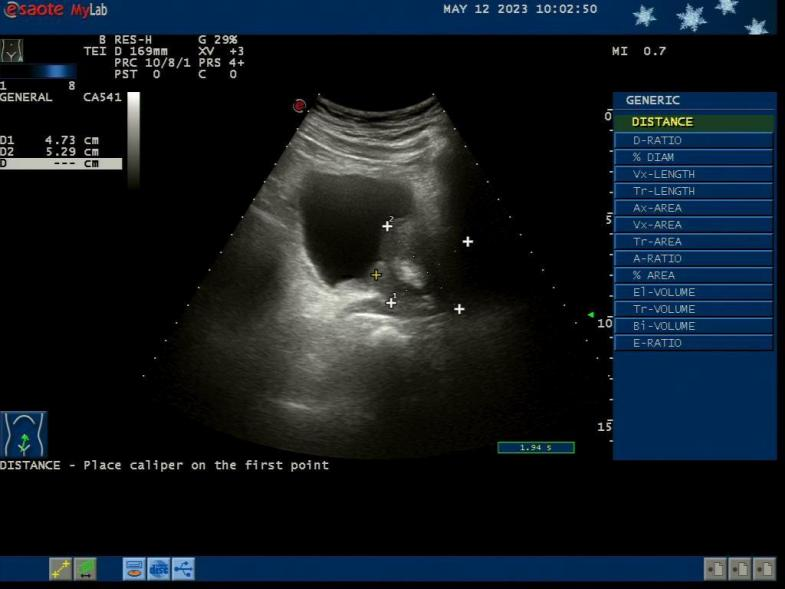
图2 超声检查
病理学诊断:前列腺癌。
临床分期:T2N1M0。
治疗经过:
予以膀胱血块冲洗,血尿好转后,使用比卡鲁胺联合地加瑞克新辅助治疗。
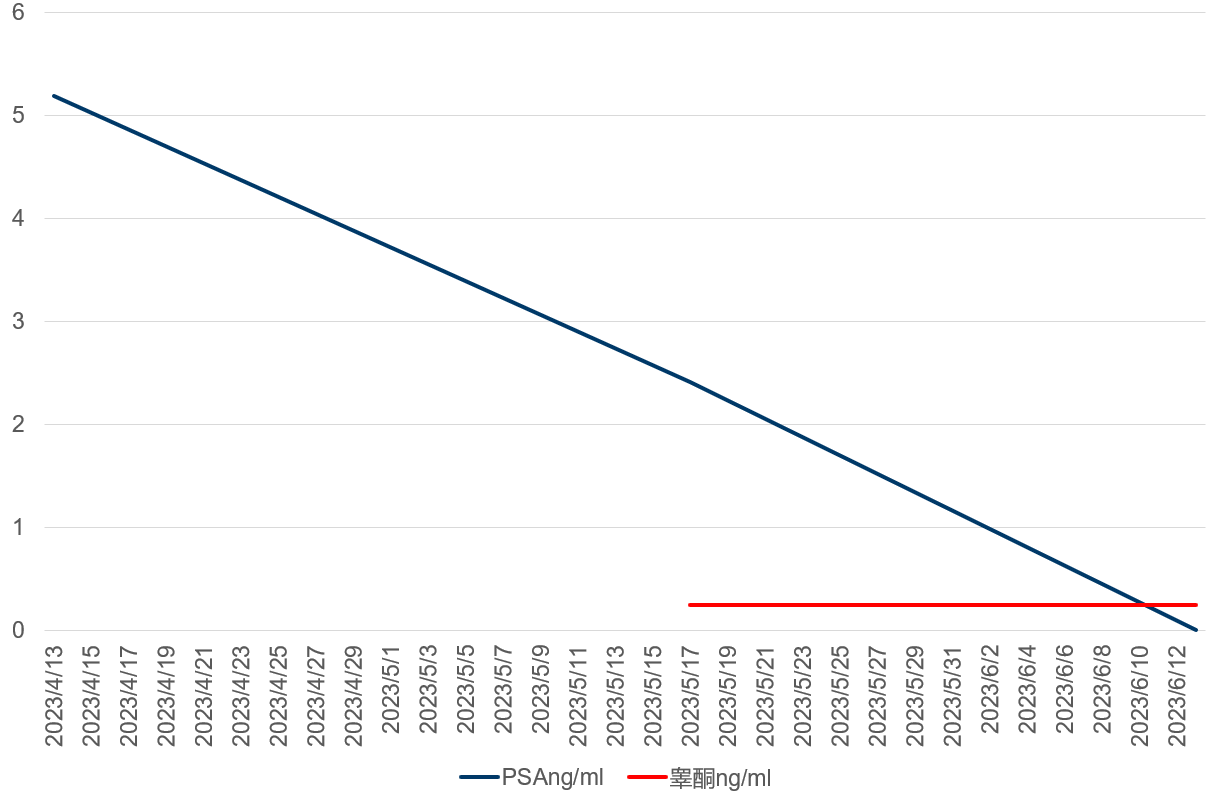
图3 PSA和睾酮水平变化情况
1个月后患者再次入院,进行机器人辅助腹腔镜前列腺根治性切除术。
术后随访:tPSA水平变化趋势。
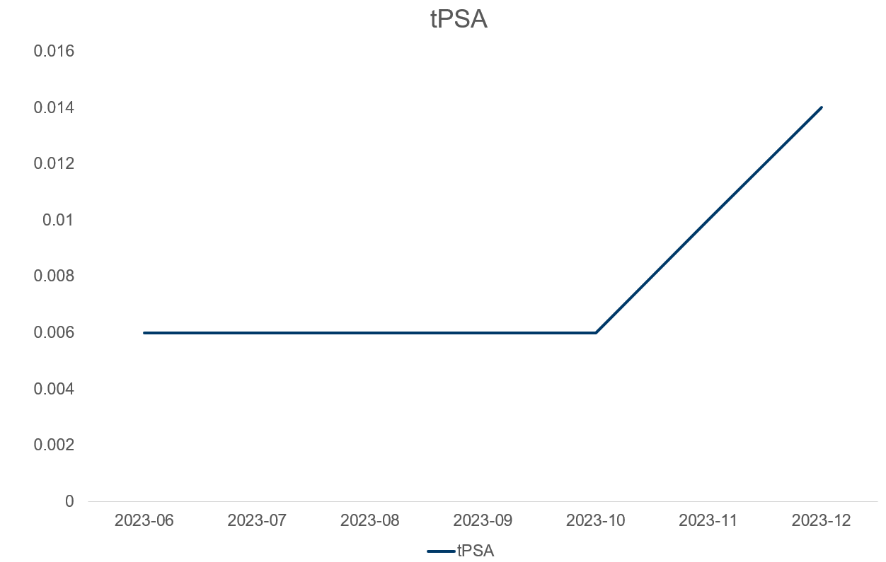
图4 tPSA变化情况
PSMA:前列腺术后,术区(膀胱尖左后部)结节样软组织密度影,无明显PSMA表达,首先考虑非前列腺癌相关病变。
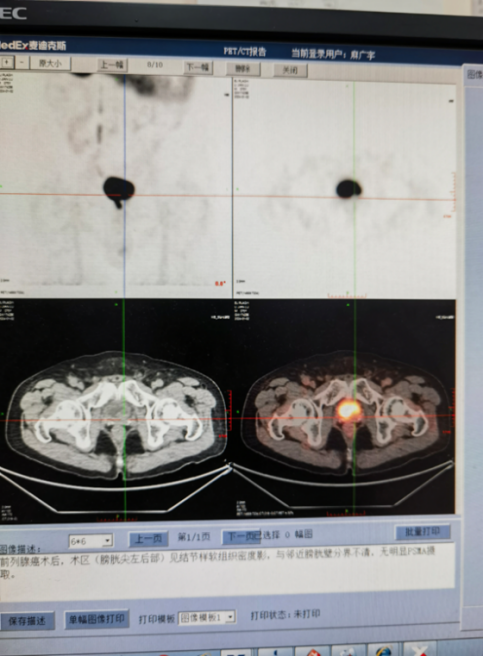
图5 PSMA检测
MRI:前列腺根治性切除术后;术区富血供结节,肿瘤复发可能性大。
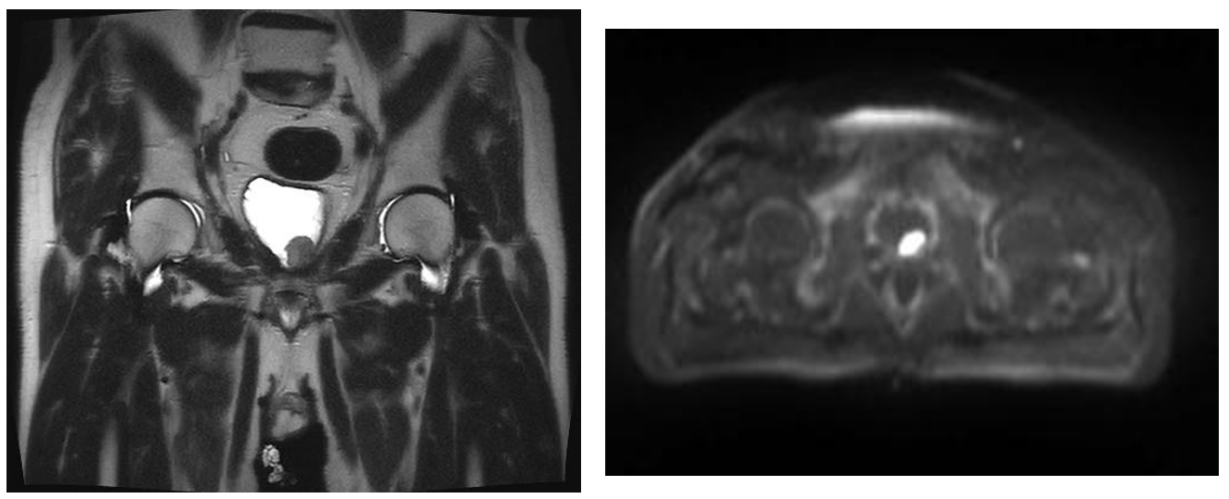
图6 MRI检查
病理学诊断:前列腺癌局部复发。
继续接受比卡鲁胺联合地加瑞克治疗,在随访过程中发现患者PSA持续上升。
疾病复发
主诉:2024年7月14日患者因下腹部疼痛,尿痛伴血尿入院就诊。
相关检查
腹部CT检查提示:前列腺切除术后改变,原前列腺区低密度板条形高密度,膀胱左侧低密度灶伴左侧肾盂输尿管扩张积水。
超声检查(双肾、输尿管、膀胱、前列腺、精囊):1、膀胱左侧壁偏高回声结节,Ca可能性大。2、左肾慢性肾实质损害伴萎缩。3、左肾积水伴左侧输尿管上段扩张。4、双肾囊肿。
术后随访:睾酮(TES)和tPSA水平变化趋势。
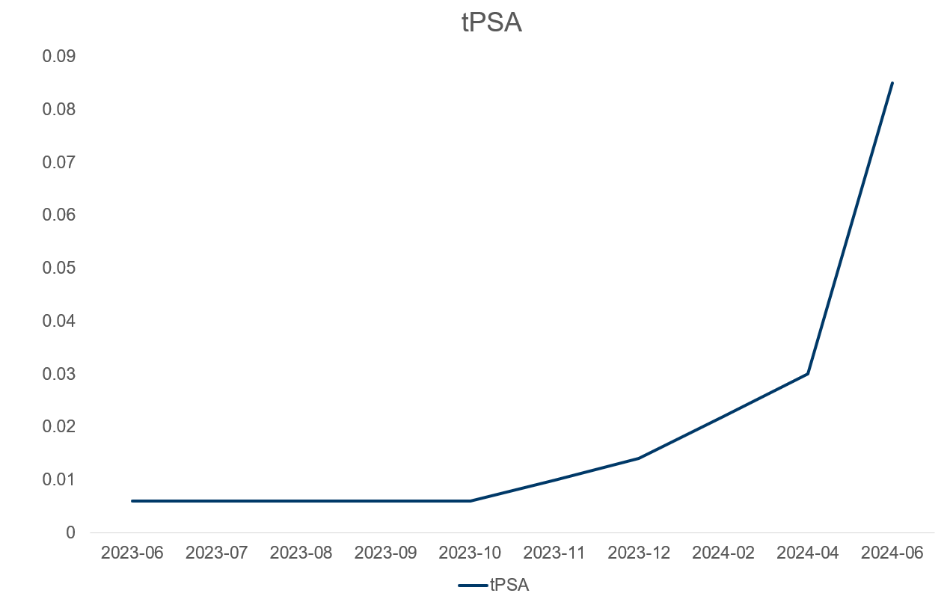
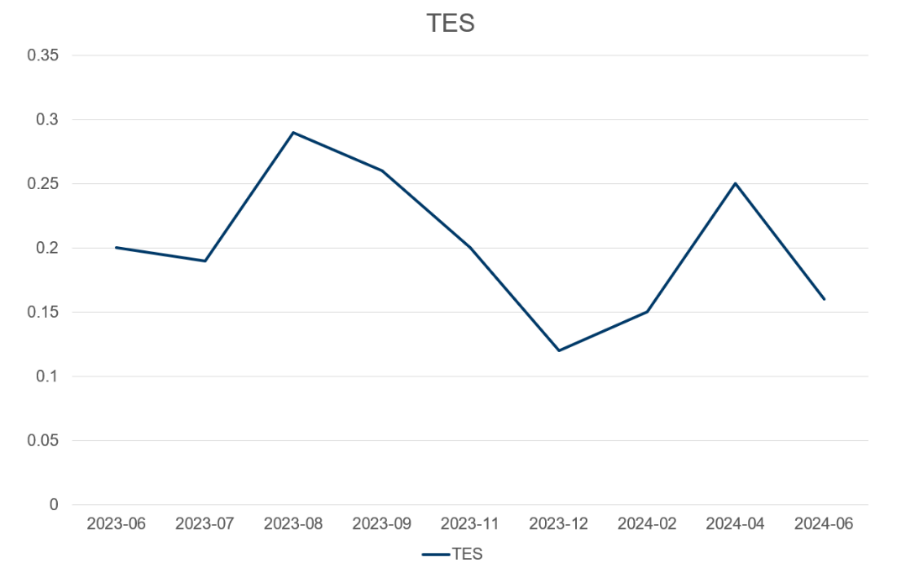
图7 tPSA和TES水平变化趋势
病理学诊断:前列腺癌局部复发(nmCRPC)。
PSMA检查:膀胱内新生物,无PSMA表达,膀胱新发肿瘤可能。
FDG-PET检查:膀胱内新生物伴高代谢,恶性可能性大,不除外前列腺转移可能,需与尿路上皮癌鉴别;脊柱及全身多发骨转移灶。
膀胱肿瘤电切术:(膀胱内新生物)低分化癌,结合病史及免疫组化结果符合前列腺腺转移癌,部分伴神经内分泌化。免疫组化结果:NKX3.1(部分+),CK7(散在+),CK20(散在+),CK5(局灶弱+),P63(-),CD56(局部+),PSA(-),GATA3(-),p40(-),Syn(部分+),INSMA(部分+),S-100P(散在+),Ki-67(80%)。
基因检测:Ⅱ类突变:MAP2K1突变丰度4%、RET突变丰度19%。Ⅲ类突变:SMO突变丰度11%、TET2突变丰度5%。
治疗经过
将比卡鲁胺更改为达罗他胺,继续联合地加瑞克治疗。
术后随访:tPSA变化趋势。
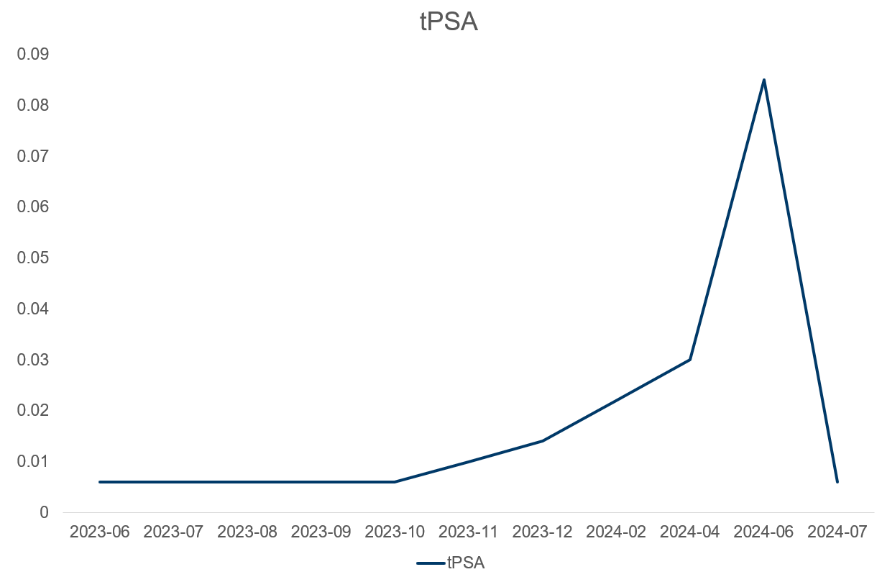
图8 术后tPSA变化趋势
专家点评
王保军教授:地加瑞克在前列腺癌全程管理中的关键作用
ADT是治疗前列腺癌的基石,并贯穿于前列腺癌患者系统治疗的各个阶段。ADT通过阻断睾丸和肾上腺的雄激素分泌途径或抑制雄激素受体的生物学功能,显著降低血清雄激素水平,从而有效限制前列腺癌细胞的生长,成为前列腺癌新辅助内分泌治疗的重要手段。已有多项研究表明,术前新辅助治疗可以降低肿瘤分期,缩小肿瘤体积,从而提高手术切除率[1-3]。在本病例中,术前使用地加瑞克迅成功速降低了睾酮和PSA水平,抑制了肿瘤细胞增殖,减轻局部侵犯,为顺利完成手术切除创造了有利条件。与GNRH激动剂不同,地加瑞克能够在治疗初期迅速降低睾酮水平,避免了睾酮激增现象,从而为术前控制肿瘤进展提供了有效保障。
在前列腺癌根治术后,术后辅助治疗仍然是延缓疾病复发、提高长期生存率的重要策略。地加瑞克作为术后辅助治疗的一个重要选择,通过持续维持低PSA水平,显著降低疾病复发的风险。此外,地加瑞克与其他药物的联合使用,如阿比特龙、恩杂鲁胺、达罗他胺,能够进一步增强治疗效果,延缓疾病进展。
本次分享的病例中,地加瑞克在术前新辅助治疗阶段、术后辅助治疗阶段,以及疾病复发阶段中均发挥了重要作用。目前,患者依然存活,期待在后续随访中能够获得患者长期生存获益的喜讯,进一步验证地加瑞克在前列腺癌全程管理中的临床价值。
张勇教授:地加瑞克在伴骨转移前列腺癌治疗中的优势
在前列腺癌的治疗过程中,除了系统性抗肿瘤治疗外,骨转移的治疗已经成为关键组成部分。在牛少曦教授分享的病例中,通过FDG-PET扫描,发现患者存在脊柱及全身多发骨转移灶。针对该复杂病情,治疗方案选择了达罗他胺联合地加瑞克。这一联合治疗方案不仅针对了原发肿瘤的控制,还考虑到骨转移的治疗需求,力图在遏制肿瘤进展的同时,减缓骨转移相关的病理性骨折、脊髓压迫等并发症的发生。在整个治疗过程中,GnRH拮抗剂地加瑞克发挥了至关重要的作用。
GnRH拮抗剂和GnRH激动剂均可通过抑制垂体分泌促性腺激素,降低体内睾酮水平,从而减少雄性激素对前列腺癌的刺激,进而促进肿瘤的消退。然而,GnRH激动剂存在一定的缺陷,它可能通过直接或间接的机制刺激前列腺癌细胞及转移性癌细胞,导致进一步的骨破坏,尤其是在骨转移患者中,这一风险更加显著。相比之下,GnRH拮抗剂地加瑞克通过竞争性结合并阻断GnRH受体,抑制促卵泡激素(FSH)和黄体生成素(LH)的分泌,从而迅速降低睾酮水平,避免了GnRH激动剂所特有的“闪烁现象”。此外,地加瑞克的作用机制还能够有效抑制由FSH介导的癌性骨代谢,减少骨破坏的风险。因此,选择GnRH拮抗剂地加瑞克用于伴有骨转移的前列腺癌的患者是一个合理的治疗策略,在减缓疾病进展的同时,还能够改善患者的临床症状,提升生活质量。
病例提供专家简历

牛少曦 教授
医学博士,硕士生导师
解放军总医院泌尿外科学部
泌尿外科副主任医师,副教授
北京市科技新星
美国杜克大学联合培养博士,专注于前列腺癌等泌尿系肿瘤的微创治疗及基础研究。
2019年医学科学技术奖一等奖主要完成人
主持国自然一项,省部级课题一项,以第一作者发表SCI论文数篇,共计影响因子>70分,其中关于前列腺癌神经内分泌分化的机制研究发表于《Clinic Cancer Research》2019.07月的封面期刊
病例点评专家简历

王保平 教授
解放军总医院副主任医师、副教授、博导
“十四五国家重点研发计划”首席科学家
中华医学会泌尿外科分会(CUA)青年学组副组长
吴阶平医学基金会青年泌尿外科专家委员会副主委
中国自动化学会医学机器人专业委员会常务委员
微创泌尿外科杂志 副主编
中华泌尿外科杂志青年编委
中华腔镜外科杂志、临床泌尿外科杂志等编委
2023年度CUA青年杰出人才获得者
国家奖(1项)和省部级奖励(5项)获得者
泌尿外科顶刊European Urology论著4篇第一或(共同)通迅

张勇 教授
主任医师,教授,博士生导师
中国医学科学院肿瘤医院泌尿外科副主任
中国医学科学院肿瘤医院廊坊院区泌尿外科主任
中国医师协会泌尿外科分会副总干事
北京肿瘤学会泌尿肿瘤专委会主任委员
中国抗癌协会泌尿肿瘤专委会委员
中国医师协会泌尿外科分会微创与机器人学组委员兼副秘书长
中华医学会泌尿外科分会机器人学组委员
中国抗癌协会泌尿外科分会膀胱癌学组委员
北京癌症防治学会泌尿肿瘤专委会副主任委员
北京市医学会泌尿外科分会常务委员
参考文献 共3篇
评论留言